Применение проточной цитометрии для анализа жизнеспособности бактериальных клеток
 Проточная цитометрия — это мощный инструмент, который позволяет анализировать физические и химические свойства клеток в режиме реального времени. Этот метод особенно полезен для изучения бактериальных популяций, так как он обеспечивает высокую чувствительность, точность и возможность работы с большим количеством клеток. Основное преимущество проточной цитометрии заключается в том, что она позволяет одновременно оценивать несколько параметров клеток, таких как размер, структура, мембранный потенциал, активность ферментов и жизнеспособность.
Проточная цитометрия — это мощный инструмент, который позволяет анализировать физические и химические свойства клеток в режиме реального времени. Этот метод особенно полезен для изучения бактериальных популяций, так как он обеспечивает высокую чувствительность, точность и возможность работы с большим количеством клеток. Основное преимущество проточной цитометрии заключается в том, что она позволяет одновременно оценивать несколько параметров клеток, таких как размер, структура, мембранный потенциал, активность ферментов и жизнеспособность.
Преимущества проточной цитометрии
- Высокая пропускная способность: за короткое время можно проанализировать десятки тысяч клеток;
- многопараметрический анализ: возможность одновременной оценки нескольких характеристик клеток (например, размера, формы, мембранного потенциала и метаболической активности);
- чувствительность: метод позволяет обнаруживать даже небольшие изменения в состоянии клеток;
- специфичность: использование специфических красителей позволяет точно идентифицировать живые и мертвые клетки.
Примеры применения анализа жизнеспособности бактерий методом проточной цитометрии
- Оценка эффективности антибиотиков и анализ влияния антибактериальных препаратов на популяцию бактерий;
- исследование стрессовых условий и изучение воздействия факторов окружающей среды (температура, pH, осмотическое давление) на бактерии;
- контроль качества пищевых продуктов и определение наличия живых патогенных бактерий в продуктах питания;
- экологические исследования и оценка состояния бактериальных сообществ в почве, воде и других средах.
Жизнеспособность бактерий: основные понятия
Жизнеспособность бактериальных клеток определяется их способностью поддерживать метаболическую активность, сохранять целостность мембраны и выполнять другие функции, необходимые для выживания. Проточная цитометрия позволяет различать живые, мертвые и поврежденные клетки на основе различных маркеров, таких как:
- целостность мембраны: живые клетки имеют неповрежденную мембрану, которая может быть исследована с помощью красителей, проникающих только в поврежденные клетки;
- метаболическая активность: оценка активности внутриклеточных ферментов или продукции АТФ;
- морфологические изменения: размер и форма клеток могут изменяться при стрессовых условиях или гибели.
Основные методы окрашивания бактерий для анализа жизнеспособности
Для анализа жизнеспособности бактерий с использованием проточной цитометрии применяются различные флуоресцентные красители, которые позволяют дифференцировать живые и мертвые клетки.
Красители для оценки целостности мембраны
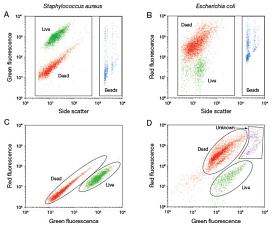
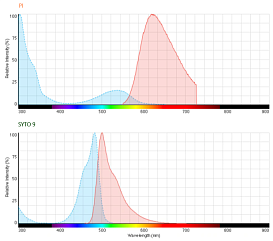
- Пропидий йодид (PI): этот краситель не проникает через неповрежденные мембраны живых клеток, но связывается с ДНК мертвых клеток, окрашивая их в красный цвет. PI широко используется для идентификации мертвых клеток.
- SYTOX Green/Red: эти красители также проникают только в клетки с нарушенной мембраной, что делает их полезными для анализа мертвых клеток.
Красители для оценки метаболической активности
- Carboxyfluorescein Diacetate: этот краситель проникает в живые клетки, где ферментативно гидролизуется до флуоресцирующего соединения. Это позволяет оценить метаболическую активность клеток.
- Резазурин (он же Alamar Blue): краситель, который восстанавливается метаболически активными клетками до флуоресцентного продукта (ресоруфина). Это широко используемый метод для оценки жизнеспособности.
Комбинированные подходы
Для более точного анализа жизнеспособности часто используют комбинацию красителей. Например:
- SYTO 9 (или LUCS 13) + Пропидий йодид (PI). Эта комбинация реализована в коммерческом наборе BacLight: SYTO 9 окрашивает все клетки (как живые, так и мертвые), а PI окрашивает только мертвые клетки. Комбинация этих красителей позволяет четко разделить живые и мертвые клетки.
Компания Стар-лаб предлагает проточные цитофлуориметы 7S (1 лазер, до 5 флуоресцентных каналов), производства, BioSino, Китай с автосемплером, которые имеют большой потенциал для проведения рутинных исследований бактериальных культур.
Не смотря на, то, что прибор оснащен всего одним лазером, тем не менее он имеет 5 каналов детекции, в том числе по каналам PI и FITC, которые используются для работы с бактериями.
Узнать больше и приборе, а также записаться на апробацию прибора в лаборатории Стар-лаб Вы можете, заполнив форму.
Информация для заказа:
|
ZS-AE7S
|
|
|
20 398 455
20 398 455 AMD
|
|
|
||||||||||||||||||||||
|
SinoCyte-S-01/96L
|
|
|
4 079 691
4 079 691 AMD
|
|
|
||||||||||||||||||||||
|
L34856
|
|
100 реакций
|
1 197 149
1 197 149 AMD
|
|
|
||||||||||||||||||||||
|
Набор для определения концентрации и жизнеспособности бактерий:
|
|||||||||||||||||||||||||||
|
3606.1000
|
|||||||||||||||||||||||||||
|
3606.1000
|
|
1 кг
|
По запросу По запросу |
|
|
||||||||||||||||||||||
|
3606.0025
|
|
25 г
|
По запросу По запросу |
|
|
||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
3606.0100
|
|
|
По запросу По запросу |
|
|
||||||||||||||||||||||
|
3606.0500
|
|
|
По запросу По запросу |
|
|
||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
См. также:
Иммунофенотипирование клеток кровиПроточный цитофлуориметр 7S (ZS-AE7S) для рутинных задач
Проточная цитометрия в биотехнологическом производстве
Определение плоидности клеток растений методом проточной цитометрии
Содержание нуклеиновых кислот в адгезирующих Т-лимфобластах линии Jurkat и их подвижность in-vitro
Ниже вы можете задать вопрос или оставить запрос в свободной форме:
Все поля со звездочкой (*) обязательны для заполнения

Данное действие необратимо.
в ближайшее время.
чтобы сделать работу на сайте еще удобнее!
С помощью личного кабинета Вы сможете:
- моментально получать счета на оформленные заказы;
- отслеживать статусы выполнения заказа по оплате, отгрузке, наличию товаров на складе;
- вести историю заказов, повторять заказы полностью или частично;
- выбирать персонального менеджера;
- формировать списки избранного среди товаров, справочных материалов и видео;
- делать заказ со страницы избранных товаров;
- экономить время при заполнении форм заказа по каталогам и регистрации на мероприятия.





















.jpg)