Среды для культивирования клеток

|
Метод культивирования клеток и тканей находит применение в биотехнологии, молекулярной и клеточной биологии, фармацевтике и др. смежных областях. Клетки, ткани или органы выделяются из животных или растений и помещаются в искусственную питательную среду для поддержания роста и/или пролиферации. Основными условиями, необходимыми для оптимального роста клеток являются: контролируемый температурный режим, субстрат для прикрепления клеток (для адгезивных культур клеток), подходящая культуральная среда, СО2-инкубатор для контроля уровня рН, поддержание осмотического давления. Наиболее важным моментом для обеспечения оптимального роста/пролиферации клеток является выбор подходящей культуральной среды. Культуральная среда представляет собой жидкость или гель, разработанная для поддержания роста/пролиферации клеток различного происхождения. Среда для культивирования клеток состоит из определенного соотношения аминокислот, витаминов, солей, глюкозы, гормонов, факторов прикрепления, факторов роста; поддерживает буферную систему и осмотическое давление. |
Основные компоненты культуральной среды.
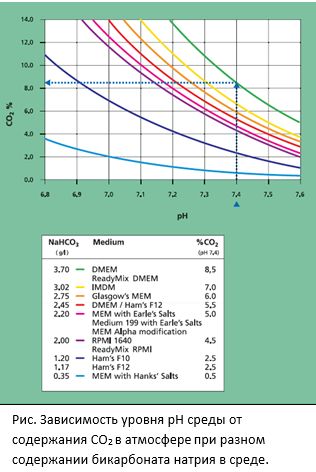 |
Бикарбонат натрия поддерживает «естественную» буферную систему культуральной среды (CO32- /HCO3-); требуя содержания 5-10 % СО2 в атмосфере, что легко выполнимо при культивировании клеток в СО2-инкубаторе. ХЕПЕС представляет собой фосфатную соль с буферной емкостью в пределах 7,2-7,4 рН. Не требует контролируемой газовой среды, но в больших концентрациях может быть токсичен для некоторых типов клеток. Феноловый красный используется как индикатор рН: красный при рН 7,4 и меняет свой цвет до оранжевого или желтого при уменьшении значения рН. Для культивирования клеток, чувствительных к эстрогену рекомендуется использовать среду без фенола красного. |
так же важна, как уровень рН при культивировании клеток. Оптимальное значение осмоляльности лежит в пределах 260-340 мосмоль/кг в зависимости от типа культивируемых клеток.
НАДФН и нуклеотиды, являясь вторичным источником энергии для метаболизма клетки. Заменимые аминокислоты также иногда добавляются в культуральную среду.
|
воду, соли, гормоны и витамины и транспортирует их между клетками и тканями. Фибронектин играет ключевую роль в адгезии клеток. Трансферрин – белок-переносчик железа, обеспечивающий железом клеточную мембрану.
Особенно важны при бессывороточном культивировании, так как сыворотка обычно содержит их. |
|

|
альбуминов, факторов роста и ингибиторов роста; является источником витаминов, аминокислот, белков, углеводородов, жиров, микроэлементов, факторов роста. Наиболее часто используют бычью и телячью эмбриональную сыворотку. Факторы роста, цитокины, гормоны добавляются в культуральную среду для пролиферации и активации клеток. Антибиотики добавляются для предотвращения контаминации культуральной среды бактериями и грибами; однако антибиотики не предотвращают заражение культуральной среды микоплазмой. |
Выбор культуральной среды.
|
Среда MEM (Minimum Essential Medium), или среда Игла была разработана Гари Иглом и является наиболее распространенной средой для культивирования клеток наряду со средой DMEM. Среда МЕМ содержит 13 аминокислот, 6 водорастворимых витаминов, холин и инозит, выполняющие роль углеводородного субстрата. Есть модификации среды МЕМ с солями Эрла и Хэнкса, а также α-модификация среды MEM с содержанием всех 21 аминокислот и солями Эрла. Среда DMEM (Dulbecco′s Modified Eagle′s Medium) является модификацией среды BME (Basal Medium Eagle) и содержит в четыре раза больше аминокислот и витаминов, а также различные добавки, улучшающие рост клеток. Изначально среда DMEM была с содержанием глюкозы 1г/л и применялась для культивирования эмбриональных клеток мыши. Затем появились модификации среды DMEM (с высоким и пониженным содержанием глюкозы, пирувата натрия, различных добавок) для культивирования клеток различных типов, в том числе нетрансформированных клеток и гибридом. Среда DMEM является наиболее распространенной средой для культивирования клеток наряду со средой MEM. |
|
|
Среда DMEM/F-12 в соотношении 1:1 применяется для выращивания широкого спектра клеточных культур. Изначально среда F12 была разработана для бессывороточного культивирования СНО клеток, клеток легких и мышиных L-клеток. В связи с богатым содержанием питательных веществ в среду DMEM/F12 можно добавлять относительно небольшое количество эмбриональной бычьей сыворотки (FBS–fetal bovine serum), либо использовать без сыворотки, но тогда необходимо добавлять такие факторы, как инсулин, трансферин, эпидермиальный фактор роста и др.. Среда RPMI-1640 была разработана в Roswell Park Memorial Institute (откуда и берет свое название) в 1966 Муром и его коллегами для культивирования лейкоцитов. В настоящее время используется для широкого спектра клеточных культур. Среда IMDM (Iscove’s Modified Dulbecco’s Medium) - это модификация среды DMEM, содержащая селенит натрия, добавочные аминокислоты и витамины, пируват натрия, ХЕПЕС и нитрат калия вместо нитрата железа. Среда IMDM используется для поддержания культуры клеток В лимфоцитов, В клеток, стимулированных полисахаридами, Т лимфоцитов и гибридом. Среда 199 первоначально была разработана для поддержания культуры первичных эксплантов. В настоящее время среда 199 применяется для продукции вакцин, культивирования первичных эксплантов и тканей хрусталика. Изначально среда 199 готовилась с солями Эрла, но есть модификация среды 199 с солями Хэнкса. Среды F-12 и F-10 изначально были разработаны Хэмом (Ham′s nutrient mixture) для культивирования СНО клеток, HeLa и мышиных L-клеток. Обе среды были разработаны для бессывороточного культивирования. Среда F-12 применяется для культивирования широкого спектра клеток млекопитающих и гибридом. Среда Грейса (Grace’s Insect Media) применяется для поддержания клеточных линий, полученных от бабочек и некоторых двукрылых. Среда Шнейдера (Schneider’s Insect Media) изначально разрабатывалась для дрозофилы, но может применяться и для поддержания клеточной культуры других двукрылых. Соли Хэнкса (Hanks’ Balanced Salt) изначально были разработаны для поддержания культуры клеток в атмосфере без СО2. Для диссоциации клеток применяются соли Хэнкса без ионов кальция и магния. Соли Эрла (Earle’s Balanced Salts) применяются для суспензионных культур, а также при проблеме слипания клеток. Буфер фосфатный Дульбекко применяется для промывки клеток. Кальций и магний способствуют слипанию клеток; фосфатный буфер без кальция и магния используют для суспензионных культур. |
Ранее просмотренные товары
Узнать цену
© Starlab, 2020 - 2026. Все права защищены
Вход в личный кабинет
Оформление заказа без регистрации
Для продолжения регистрации введите ИНН
Восстановление пароля
Ссылка для восстановления пароля будет отправлена на Ваш адрес электронной почты
Регистрация пользователя
Заполните, пожалуйста, форму регистрации
Все поля со звездочкой (*) обязательны для заполнения
Все поля со звездочкой (*) обязательны для заполнения

Пожалуйста, подождите, ваш запрос отправляется на обработку
Техподдержка пользователей
Для более быстрого оформления запроса выберите тему обращения
Отмена регистрации
Вы уверены, что хотите отменить создание учетной записи и удалить все данные?
Данное действие необратимо.
Данное действие необратимо.
Да, удалить
Нет, оставить
Ваш заказ будет обработан
в ближайшее время.
в ближайшее время.
Мы пришлем уведомление, как только все будет готово. Спасибо!
Зарегистрируйтесь на dia-m.ru,
чтобы сделать работу на сайте еще удобнее!
чтобы сделать работу на сайте еще удобнее!
С помощью личного кабинета Вы сможете:
- моментально получать счета на оформленные заказы;
- отслеживать статусы выполнения заказа по оплате, отгрузке, наличию товаров на складе;
- вести историю заказов, повторять заказы полностью или частично;
- выбирать персонального менеджера;
- формировать списки избранного среди товаров, справочных материалов и видео;
- делать заказ со страницы избранных товаров;
- экономить время при заполнении форм заказа по каталогам и регистрации на мероприятия.
Файлы cookie
Для повышения удобства работы с сайтом на нем используются файлы cookie.
В cookie содержатся данные о Ваших прошлых посещениях сайта. Если Вы не хотите, чтобы эти данные
обрабатывались, отключите cookie в настройках браузера.