Применение технологии микрофлюидики для получения двойных эмульсий (вода-масло-вода),для инкапсуляции нескольких эукариот.клеток
Тэги: тканевая инженерия, мезенхимальные стволовые клетки, регенеративная медицина, микрофлюидика, двойные эмульсии, lab-on-a-chip.
Абстракт
Одним из привлекательных применений в тканевой инженерии является получение в качестве “кусочков ткани” сфероидов, содержащих несколько клеток, в частности, мезенхимальных стволовых клеток. Обычный подход к получению сфероидов дает низкий выход и плохое качество сфероидов из-за большого разброса по размеру, что приводит к невозможности для клеток получать из внеклеточного матрикса сигналы для дальнейшей дифференцировки.
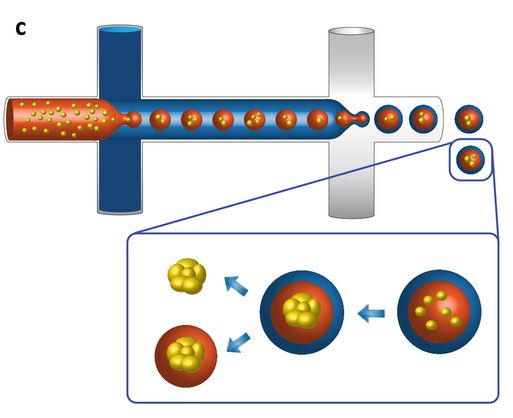
Технология микрофлюидики позволяет получить внутри двойных капель клеточные агрегаты контролируемого размера в диапазоне от 50 до 80 мкм, а затем выделить их, действуя агентом, разрушающим эмульсию. Кроме того, есть возможность в качестве внутренней фазы использовать раствор гидрогеля, который после образования клеточных сфероидов инкапсулирует их в защитную гелевую оболочку.
В приведенной научной работе использовали человеческие мезенхимальные стволовые клетки (hMSC) для получения сфероидов в альгинате и в альгинат-аргинин-глицин-аспарагиновой кислоте (альгинат-RGD). Было продемонстрировано, что полученный микрогель обладает высокой способностью к остеогенной тканевой дифференцировке (может использоваться для восстановления костной ткани - прим.)

Обзор
Агрегаты клеток (клеточные сфероиды) за счет пространственной структуры гораздо лучше моделируют условия, присутствующие in vivo, например, межклеточные взаимодействия за счет прямых клеточных контактов и химических сигналов и взаимодействия клеток с внеклеточным матриксом. Их образование обеспечивает лучшую жизнеспособность и сохранение фенотипа, который зачастую утрачивается в клеточной культуре.
Размер получаемых клеточных сфероидов может оказывать влияние на дальнейшую дифференцировку мезенхимальных стволовых клеток. В частности, небольшие размеры сфероидов приводят к более гомогенной хондрогенной дифференцировке в гиалиновые хрящи. Больший размер сфероидов приводит к более гетерогенно-дифференцированной ткани.
Инкапсуляция стволовых клеток в полиэтиленгликолевый (ПЭГ) гидрогель, конъюгированный с альгинат-RGD или с гиалуроновой кислотой приводит, соответственно, к дифференцировке по остеогенному пути (в костную ткань) или по хондрогенному пути (в хрящевую ткань).
Обычный способ получения сфероидов подразумевает суспензионное культивирование клеток во флаконах-спиннерах, что достаточно просто, но приводит к гетерогенности размеров, или в “висячих каплях”, что дает контролируемые размеры, но требует очень большого количества ручного труда. Увеличить выход можно с помощью высокопроизводительной “струйной печати” капель, но этот подход сталкивается с проблемой со слипанием нескольких капель.
Получение клеточных сфероидов по технологии микрофлюидики имеет целый ряд значимых преимуществ:
- потенциал высокой производительности за счет большого числа получаемых капель > 20 Гц (капель в секунду на канал) и линейного масштабирования с увеличением числа каналов генерации капель;
- инкапсуляция клеточных сфероидов в капли “двойной эмульсии” (вода-масло-вода) увеличивает жизнеспособность клеток за счет лучшего обеспечения клеток кислородом, питательными веществами и ростовыми факторами путем диффузии через гидрофобную оболочку;
- миниатюрное решение с точным контролем условий получения клеточных сфероидов;
- время образования сфероидов hMSC из отдельных клеток попавших в микрокапли составляет всего порядка 150 мин.
Создание сфероидов, образованных стволовыми клетками, может использоваться во многих применениях тканевой инженерии, как например, для реконструкции поврежденной печени, а также для высокопроизводительных тестов новых фармпрепаратов.
Результаты
Скорость внутренней водной фазы использовалась фиксированная - 2 мкл/мин. Диаметр внутренних капель получался в диапазоне от 65 мкм до 90 мкм (канал 100 мкм) или от 150 мкм до 210 мкм (канал 200 мкм) в зависимости от скорости потока масла, который варьировали от 3 до 15 мкл/мин. Индексы полидисперсности размера капель составили, соответственно, 0,027 и 0,022, что характеризует капли как монодисперсные.

Поскольку при получении двойных эмульсий попадание водных капель в масляные - это вероятностный процесс, то образуется малое количество масляных капель, внутрь которых не попало ни одной водной капли, и малое количество масляных капель, внутрь которых попало более одной водной капли.

Была также проанализирована проницаемость масляной оболочки для флуоресцирующих веществ с различной молекулярной массой. Вещества с молекулярной массой порядка 0,4 кДа свободно диффундировали через масло, в то время, как полимеры с молекулярным весом порядка 70 кДа уже не могли покинуть капли. Среди низкомолекулярных веществ с одинаковой молекулярной массой проницаемость коррелировала с коэффициентом распределения масло/вода для соответствующего вещества. Так красители Родамин 6G, Родамин B и FITC (флуоресцеин изотиоционат) имеют сопоставимую молекулярную массу и коэффициенты распределения 0,87, 0,26 и 0,08, и проницаемость масляной оболочки двойных эмульсий в их ряду падает соответственно.
Распределение количества клеток, попавших внутрь капель в соответствии с предыдущими результатами подчинялось закону Пуассона. Высокая жизнеспособность клеток, попавших в капли наблюдалась в течение 4-х дней.
Культивирование клеток hMSC на плоской поверхности с добавлением в среду растворенного в масле сурфактанта (детергента) в течение одних суток приводило к формированию агрегатов клеток, что не наблюдали, если клетки культивировались с добавлением в культуральную среду одного только масла.

В то же время, внутри капель двойной эмульсии клетки агрегировали и образовывали сфероиды в течение 150 минут за счет эффекта ограничения объема (microscale confinement), который способствовал межклеточным взаимодействиям. Частота формирования сфероидов из отдельных клеток в каплях составила почти 100%.
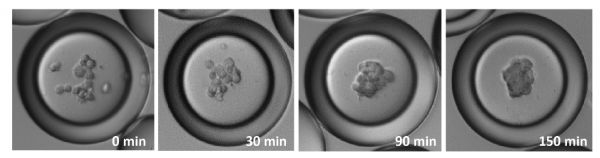
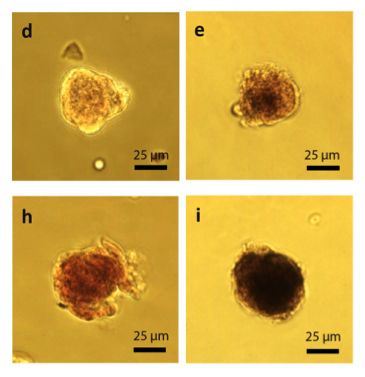
Для подтверждения этих выводов эффект был исследован и продемонстрирован на нескольких различных типах клеток: PMEF, HepG2 (компактные сфероиды образовывались через 2 часа) и Caco-2 (сфероиды формировались через 6 часов), что может объясняться различной аффинностью клеток при межклеточных взаимодействиях.
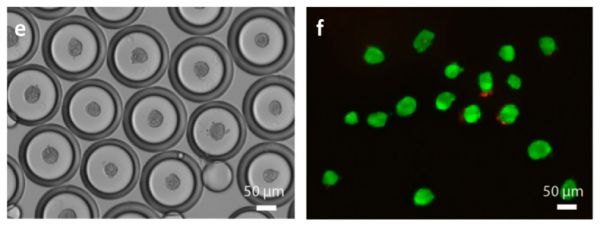
Извлекали компактные сфероиды, образованные любым приведенным типом клеток, с помощью химического агента, разрушающего эмульсию. Выход в результате процедуры сфероидов с высокой клеточной жизнеспособностью достигал 95%.
Размер образующихся сфероидов контролировали, варьируя плотность: 2, 5, 10, и 20 миллионов клеток на мл клеточной суспензии, используемой для инкапсуляции клеток в канале 200 мкм давали в среднем примерно 8, 20, 40 и 80 клеток на одну каплю, что приводило к получению сфероидов диаметром 36, 46, 62 и 84 мкм, соответственно.
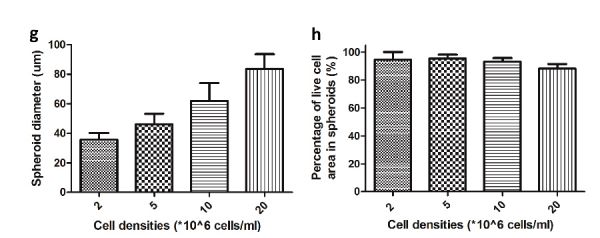
Количество жизнеспособных клеток в каждом сфероиде колебалось от 88 до 96 % для разных размеров сфероидов. При помещении сфероида на плоскую подложку клетки были обладают способностью прикрепляться к ней и распространяться, снова образуя прикрепленную клеточную культуру.

Мезенхимальные стволовые клетки hMSC, образовавшие сфероиды показывали лучшую готовность дифференцироваться в адипоциты (клетки жировой ткани), чем клетки, культивируемые на плоской поверхности.
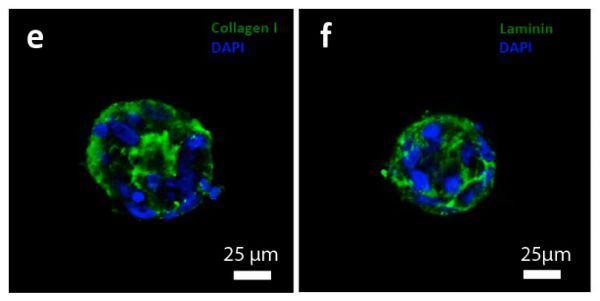
Также было показано, что клетки, образовавшие сфероиды формируют сложную пространственную сеть внеклеточного белкового матрикса, включающего коллаген I типа и ламинин, которая напоминает внеклеточный матрикс, наблюдаемый в тканях in vivo.
Капли, содержащие во внутренней фазе микрогель альгинат или альгинат-RGD, которые помещали в среду, содержащую ионы Ca2+, что приводило к образованию кросс-сшивок между цепями альгината и формировало трехмерную пространственную пористую структуру с образованием твердого геля. Клетки hMSC сфероидов в обоих случаях показывали экспрессию E-кадгерина, а в случае альгинат-RGD также экспрессировался интегрин α5β1, что может привести к заключению, что аминокислотная последовательность RGD (аргинин-глицин-аспартат) приводила к экспрессии рецепторов на поверхности клетки, которые могли бы в дальнейшем направить дифференцировку клетки по остеогенному пути, что наблюдалось в одном из экспериментов. Через 7 дней после культивирования сфероидов, инкапсулированных в альгинат-RGD гель, наблюдалось повышенное содержание кальциевых депо (окраска ализариновым красным) и повышенная активность щелочной фосфатазы, что свидетельствует о начале дифференцировке в костную ткань.
Использование масла HFE-7500 было выбрано за его высокую проницаемость для молекулярного кислорода. Для стабилизации капель двойной эмульсии и ускорения агрегации клеток в сфероиды применялся сурфактант (детергент) Pico-Surf I, имеющий гидрофильную часть, препятствующую слипанию капель, аналогичную полиэтиленгликолю (ПЭГ); аналогично может быть использован сурфактант PEG-PFPE.
По материалам статьи “Rapid formation of multicellular spheroids in double-emulsion droplets with controllable microenvironment”. Hon Fai Chan, Ying Zhang, Yi-Ping Ho, Ya-Ling Chiu, Youngmee Jung, Kam W. Leong. Scientific Reports, 3:3462.
Закажите демонстрацию системы Dolomite по телефону +7 (495) 745-05-08 доб. 134 или отправьте заявку на почту Dmitriy.Brittal@star-lab.am.
Все поля со звездочкой (*) обязательны для заполнения

Данное действие необратимо.
в ближайшее время.
чтобы сделать работу на сайте еще удобнее!
С помощью личного кабинета Вы сможете:
- моментально получать счета на оформленные заказы;
- отслеживать статусы выполнения заказа по оплате, отгрузке, наличию товаров на складе;
- вести историю заказов, повторять заказы полностью или частично;
- выбирать персонального менеджера;
- формировать списки избранного среди товаров, справочных материалов и видео;
- делать заказ со страницы избранных товаров;
- экономить время при заполнении форм заказа по каталогам и регистрации на мероприятия.