|
LSM 700
|
|
|
Регистрационное удостоверение на медицинское изделие
Росздравнадзора
|
По запросу По запросу |
|
|
|||||
|
Компактный представитель лазерных сканирующих микроскопов серии LSM 7, в средней ценовой категории, для рутинных задач биологии, медицины и материаловедения. Главным преимуществом является прецизионное спектральное сканирование с уникальным вариабельным вторичным делителем луча. LSM 700 - компактный конфокальный лазерный сканирующий микроскоп. Уникальная конструкция в сочетании с чувствительными детекторами позволяет максимально минимизировать потери сигнала. Микроскоп оснащен полупроводниковыми светодиодными лазерами, которые являются надежными, долговечными и стабильными в работе источниками возбуждения. Так как лазерные линии микроскопа LSM 700 равномерно распределены по оптическому спектру, нам достаточно всего четырех лазерных линий для работы со всеми известными флуоресцентными красителями. Система детекции микроскопа имеет два детектора на основе сверхчувствительных фотоэлектронных умножителей, при этом благодаря уникальному запатентованному вторичному делителю луча «VSD» мы можем производить спектральное сканирование без использования многоканальных громоздких детекторов. Такая конструкция делает дизайн микроскопа компактным и удобным для эксплуатации. Современное программное обеспечение ZEN 2012 обладает функцией Smart Setup, которая позволяет работать на микроскопе даже начинающему пользователю. Вам просто необходимо выбрать нужные флуоресцентные красители из списка, остальные настройки системы программа сделает самостоятельно. Эта функция, а также возможность сочетать любые режимы (временные серии, Z–Стэки, области интереса, и.т.п) в одном эксперименте, является ключевым преимуществом ZEN. Кроме того, программа имеет расширенные возможности по трехмерной реконструкции объектов из полученных серий оптических срезов.
Технические характеристики:
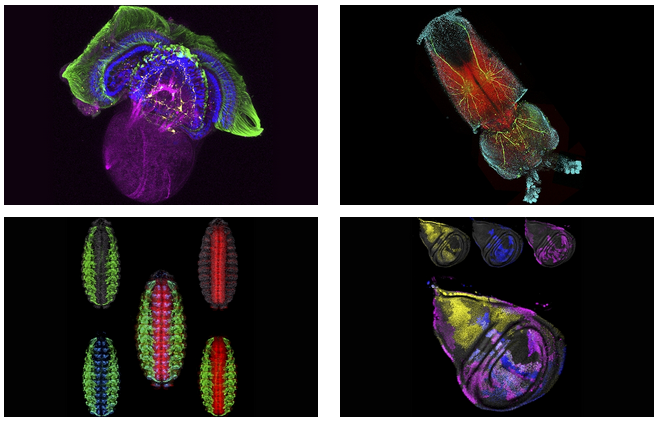
Развитие генной инженерии, протеомики, биотехнологии, современной фармацевтики и биомедицины способствовало быстрому внедрению новых методов конфокальной микроскопии, и в настоящее время они широко используются в клеточной биологии. Конфокальную флуоресцентную микроскопию можно рассматривать как разновидность традиционной флуоресцентной микроскопии, которая позволяет исследовать внутреннюю микроструктуру клеток, причем не только фиксированных, но и живых, идентифицировать микроорганизмы, структуры клетки и отдельные молекулы, наблюдать динамические процессы в клетках. Конфокальная флуоресцентная микроскопия в дополнение к этому обеспечила возможность трехмерного субмикронного разрешения объекта и существенно расширила возможность неразрушающего анализа прозрачных образцов. Повышение разрешающей способности достигается благодаря использованию в конфокальных микроскопах лазеров в качестве источников света и конфокальной диафрагмы для фильтрации внефокусной флуоресценции. Преимущество лазеров по сравнению с ртутными или ксеноновыми лампами заключается в монохроматичности и высокой параллельности испускаемого пучка света. Эти свойства лазерного излучения обеспечивают более эффективную работу оптической системы микроскопа, уменьшают число бликов, улучшают точность фокусировки пучка света. На образце лазер освещает не все поле зрения, как в ламповом флуоресцентном микроскопе, а фокусируется в точку. Конечно, при этом лазерный луч возбуждает флуоресценцию как в точке фокуса, так и во всех слоях образца, через которые проходит. И если эта внефокусная флуоресценция, излучаемая слоями, расположенными выше и ниже фокальной плоскости, регистрируется вместе с основным сигналом из фокуса объектива, это ухудшает разрешение оптической системы. Избавиться от внефокусной флуоресценции позволяет конфокальная диафрагма. Изменяя диаметр конфокальной диафрагмы, можно определять толщину оптического слоя вблизи фокуса лазерного луча, поэтому флуоресценция, испускаемая выше и ниже фокуса, оказывается дефокусированной на конфокальной диафрагме и не регистрируется. Благодаря этому конфокальная микроскопия обеспечивает улучшенное разрешение, в первую очередь вдоль оси Z. Современная конфокальная микроскопия позволяет решать три основные задачи: изучение тонкой структуры клетки, колоколизации (пространственного взаиморасположения) в клетке двух или более веществ, а так же исследование динамических процессов, протекающих в живых клетках. Благодаря улучшенному разрешению, особенно повышенному разрешению по оси Z, и возможности создавать серии «оптических» срезов, конфокальный микроскоп позволяет исследовать тонкую структуру объекта в трехмерном пространстве. Специальные программы позволяют создать из серии оптических срезов объемное изображение объекта (3D) и как бы рассматривать его под разными углами зрения, что может дать ценную информацию о форме клеток, цитоскелете, структуре ядра, хромосомах и даже локализации в них отдельных генов, а так же о взаиморасположении этих элементов. Использование мультиспектрального (с несколькими флуорохромами) режима работы лазерного сканирующего конфокального микроскопа позволяет исследовать колоколизацию (пространственное взаиморасположение) в клетке двух или более разных веществ, например, белков, помеченных разными флуоресцентными красителями. Исследуя такие препараты в обычном флуоресцентном микроскопе, нельзя с уверенностью утверждать, находятся эти вещества рядом или одно под другим. С помощью метода оптических срезов и дальнейшей 3D-реконструкции объекта можно воссоздать объемное распределение веществ. Мультиспектральный режим так же позволяет проводить на конфокальном микроскопе исследования методом FISH. Возможность получать временные серии изображений с высоким пространственным разрешением позволяет исследовать изменения, происходящие в клетках и их структурах во времени (4D реконструкция). Кроме того, благодаря наличию лазеров и системы сканирования можно осуществлять не только регистрацию временных изменений, но и осуществлять воздействие на клеточные структуры лазерным излучением с одновременным наблюдением протекающих процессов. Новые методы лазерной сканирующей конфокальной микроскопии получили широкое распространение в фундаментальных науках, а также все шире применяются в практических исследованиях и диагностической медицине. Методы конфокальной микроскопии позволяют выявить способность веществ накапливаться в цитоплазме, ядре или других структурах клетки, зарегистрировать образование метаболитов, измерить кинетику накопления и метаболизма веществ в клетке, скорость выведения веществ из клетки, сравнить интенсивность метаболизма в различных клеточных линиях и в различных условиях. Эти методы все шире применяются в исследованиях механизмов действия как канцерогенов, так и лекарственных препаратов и противоопухолевых соединений, позволяют рассчитывать их эффективные концентрации. Анализ интенсивности и формы спектров собственной флуоресценции позволяет распознавать нормальные и воспаленные клетки, и такой метод, в частности, предложен в качестве нового способа ранней диагностики шейки матки. Подобрав комбинацию фильтров для нескольких типов собственной флуоресценции, возможно без проведения гистохимического окрашивания и трудоемкого получения и исследования множества срезов различать злокачественные и нормальные тканевые структуры в биопсийных пробах лимфоузлов пациентов с лимфоаденопатией различного происхождения. Методы конфокальной микроскопии широко применяются в эмбриологии и гидробиологии, ботанике, зоологии при изучении структуры гамет, развития и формирования организмов. Конфокальная микроскопия постоянно развивается, и в практику внедряются все новые методы исследований для изучения механизмов функционирования организмов на клеточном, субклеточном и молекулярном уровнях, которые с каждым днем становятся все более востребованными в прикладных исследованиях и диагностике. Появление персонального конфокального лазерного сканирующего микроскопа FV10i позволяет расширить границы применения конфокальных методик. Микроскоп FV10i выполняет те же функции, что и высокотехнологичные исследовательские конфокальные сканирующие системы FV1000. В компактный корпус интегрированы все основные компоненты: 4 диодных лазера, спектральный сканирующий детектор, интуитивно понятное программное обеспечение, инкубатор, моторизованный столик, антивибрационная платформа и даже «темная комната». Этот микроскоп идеален для тех, кто только начинает работать с конфокальным методиками, для тех, кто хотел бы освободить исследовательские конфокальные микроскопы от рутинных задач, для диагностических лабораторий, лабораторий с ограниченным бюджетом, для обучающих задач и случаев проведения исследований в условиях ограниченного комфорта, например, на биологических станциях. |
|||||||||||
|
LSM710
|
|
|
Регистрационное удостоверение на медицинское изделие
Росздравнадзора
|
По запросу По запросу |
|
|
|||||
|
Конфокальный лазерный сканирующий микроскоп с уникальной оптической схемой и системой детектирования, которые позволяют получать оптические срезы с максимальной эффективностью. Вы можете работать с мультиканальной флуоресценцией вплоть до десяти красителей и использовать непрерывную спектральную детекцию во всем видимом диапазоне длин волн. LSM 710 на инвертированном штативе микроскопа Axio Observe Z1 - это непревзойденный конфокальный микроскоп для клеточной биологии и биологии развития. Совместно с прямым штативом AxioImager или AxioEmainer - LSM 710 превращается в инструмент для работы в нейробиологии, физиологии и изучении биовзаимодействий в самом широком спектре экспериментов. Оптическая схема предполагает использование до восьми лазерных портов и любую комбинацию лазерных линий от близкого УФ спектра до ИК. 34-канальный модуль детекции QUASAR позволяет оптимальную стратегию захвата для различных спектров излучения, без привязки к фильтрам и дихроичным зеркалам. Вы всегда можете направить любую часть спектра сигнала на любой выбранный Вами детектор. Спектральное сканирование предполагает эксперименты с высоким разрешением и обнаружением до 10 каналов одновременно. В сканирующем модуле LSM 710 используется передовое техническое решение: возвратный контур спектральной переработки (Spectral Recycling Loop), обеспечивающий усиление сигнала за счет многократного повторного пропускания через спектральную решетку всех неразделенных частей флуоресцентного сигнала. Коррекция плоскости поляризации части флуоресценции увеличивает суммарный эмиссионный сигнал в среднем на 15 -17 %! Модификация LSM 710 NLO - это лазерный сканирующий микроскоп, оснащенный фемтосекундным мультифотонным лазером, генерирующим излучение высокой плотности в инфракрасной области 680-1080 нм. Благодаря свойствам такого лазера мы можем проникать на глубину до 500 мкм, при этом возбуждение происходит только внутри фокального микрообъема, менее 0,1 мкм3, что позволяет бережно воздействовать на живую ткань.
Технические характеристики:
Развитие генной инженерии, протеомики, биотехнологии, современной фармацевтики и биомедицины способствовало быстрому внедрению новых методов конфокальной микроскопии, и в настоящее время они широко используются в клеточной биологии. Конфокальную флуоресцентную микроскопию можно рассматривать как разновидность традиционной флуоресцентной микроскопии, которая позволяет исследовать внутреннюю микроструктуру клеток, причем не только фиксированных, но и живых, идентифицировать микроорганизмы, структуры клетки и отдельные молекулы, наблюдать динамические процессы в клетках. Конфокальная флуоресцентная микроскопия в дополнение к этому обеспечила возможность трехмерного субмикронного разрешения объекта и существенно расширила возможность неразрушающего анализа прозрачных образцов. Повышение разрешающей способности достигается благодаря использованию в конфокальных микроскопах лазеров в качестве источников света и конфокальной диафрагмы для фильтрации внефокусной флуоресценции. Преимущество лазеров по сравнению с ртутными или ксеноновыми лампами заключается в монохроматичности и высокой параллельности испускаемого пучка света. Эти свойства лазерного излучения обеспечивают более эффективную работу оптической системы микроскопа, уменьшают число бликов, улучшают точность фокусировки пучка света. На образце лазер освещает не все поле зрения, как в ламповом флуоресцентном микроскопе, а фокусируется в точку. Конечно, при этом лазерный луч возбуждает флуоресценцию как в точке фокуса, так и во всех слоях образца, через которые проходит. И если эта внефокусная флуоресценция, излучаемая слоями, расположенными выше и ниже фокальной плоскости, регистрируется вместе с основным сигналом из фокуса объектива, это ухудшает разрешение оптической системы. Избавиться от внефокусной флуоресценции позволяет конфокальная диафрагма. Изменяя диаметр конфокальной диафрагмы, можно определять толщину оптического слоя вблизи фокуса лазерного луча, поэтому флуоресценция, испускаемая выше и ниже фокуса, оказывается дефокусированной на конфокальной диафрагме и не регистрируется. Благодаря этому конфокальная микроскопия обеспечивает улучшенное разрешение, в первую очередь вдоль оси Z. Современная конфокальная микроскопия позволяет решать три основные задачи: изучение тонкой структуры клетки, колоколизации (пространственного взаиморасположения) в клетке двух или более веществ, а так же исследование динамических процессов, протекающих в живых клетках. Благодаря улучшенному разрешению, особенно повышенному разрешению по оси Z, и возможности создавать серии «оптических» срезов, конфокальный микроскоп позволяет исследовать тонкую структуру объекта в трехмерном пространстве. Специальные программы позволяют создать из серии оптических срезов объемное изображение объекта (3D) и как бы рассматривать его под разными углами зрения, что может дать ценную информацию о форме клеток, цитоскелете, структуре ядра, хромосомах и даже локализации в них отдельных генов, а так же о взаиморасположении этих элементов. Использование мультиспектрального (с несколькими флуорохромами) режима работы лазерного сканирующего конфокального микроскопа позволяет исследовать колоколизацию (пространственное взаиморасположение) в клетке двух или более разных веществ, например, белков, помеченных разными флуоресцентными красителями. Исследуя такие препараты в обычном флуоресцентном микроскопе, нельзя с уверенностью утверждать, находятся эти вещества рядом или одно под другим. С помощью метода оптических срезов и дальнейшей 3D-реконструкции объекта можно воссоздать объемное распределение веществ. Мультиспектральный режим так же позволяет проводить на конфокальном микроскопе исследования методом FISH. Возможность получать временные серии изображений с высоким пространственным разрешением позволяет исследовать изменения, происходящие в клетках и их структурах во времени (4D реконструкция). Кроме того, благодаря наличию лазеров и системы сканирования можно осуществлять не только регистрацию временных изменений, но и осуществлять воздействие на клеточные структуры лазерным излучением с одновременным наблюдением протекающих процессов. Новые методы лазерной сканирующей конфокальной микроскопии получили широкое распространение в фундаментальных науках, а также все шире применяются в практических исследованиях и диагностической медицине. Методы конфокальной микроскопии позволяют выявить способность веществ накапливаться в цитоплазме, ядре или других структурах клетки, зарегистрировать образование метаболитов, измерить кинетику накопления и метаболизма веществ в клетке, скорость выведения веществ из клетки, сравнить интенсивность метаболизма в различных клеточных линиях и в различных условиях. Эти методы все шире применяются в исследованиях механизмов действия как канцерогенов, так и лекарственных препаратов и противоопухолевых соединений, позволяют рассчитывать их эффективные концентрации. Анализ интенсивности и формы спектров собственной флуоресценции позволяет распознавать нормальные и воспаленные клетки, и такой метод, в частности, предложен в качестве нового способа ранней диагностики шейки матки. Подобрав комбинацию фильтров для нескольких типов собственной флуоресценции, возможно без проведения гистохимического окрашивания и трудоемкого получения и исследования множества срезов различать злокачественные и нормальные тканевые структуры в биопсийных пробах лимфоузлов пациентов с лимфоаденопатией различного происхождения. Методы конфокальной микроскопии широко применяются в эмбриологии и гидробиологии, ботанике, зоологии при изучении структуры гамет, развития и формирования организмов. Конфокальная микроскопия постоянно развивается, и в практику внедряются все новые методы исследований для изучения механизмов функционирования организмов на клеточном, субклеточном и молекулярном уровнях, которые с каждым днем становятся все более востребованными в прикладных исследованиях и диагностике. Появление персонального конфокального лазерного сканирующего микроскопа FV10i позволяет расширить границы применения конфокальных методик. Микроскоп FV10i выполняет те же функции, что и высокотехнологичные исследовательские конфокальные сканирующие системы FV1000. В компактный корпус интегрированы все основные компоненты: 4 диодных лазера, спектральный сканирующий детектор, интуитивно понятное программное обеспечение, инкубатор, моторизованный столик, антивибрационная платформа и даже «темная комната». Этот микроскоп идеален для тех, кто только начинает работать с конфокальным методиками, для тех, кто хотел бы освободить исследовательские конфокальные микроскопы от рутинных задач, для диагностических лабораторий, лабораторий с ограниченным бюджетом, для обучающих задач и случаев проведения исследований в условиях ограниченного комфорта, например, на биологических станциях. |
|||||||||||
|
LSM780
|
|
|
Регистрационное удостоверение на медицинское изделие
Росздравнадзора
|
По запросу По запросу |
|
|
|||||
|
Конфокальный лазерный сканирующий микроскоп, обладающий уникальными характеристиками по чувствительности. 32-канальный спектральный детектор GaAsP имеет квантовую эффективность и соотношение сигнал-шум почти в два раза выше, чем обычные детекторы на основе ФЭУ. LSM 780 - конфокальный лазерный сканирующий микроскоп, обладающий уникальными характеристиками по чувствительности. 32-канальный спектральный детектор GaAsP имеет квантовую эффективность и соотношение сигнал-шум почти в два раза выше, чем обычные детекторы на основе ФЭУ. Такие выдающиеся характеристики получены благодаря использованию Галлий-Арсенид-Фосфора - полупроводникового материала с идеальными характеристиками для преобразования фотонов в электрический сигнал. Благодаря такой чувствительности вы проводите эксперименты с меньшим временем воздействия на образец и меньшими мощностями лазера, что является ключевым преимуществом в изучении живых клеток. Благодаря инновационной системе детекции, возможно проведение флуоресцентной корреляционной спектроскопии и подсчет фотонов без дополнительных внешних датчиков. В составе LSM 780 доступен уникальный ультрафиолетовый лазер с длиной волны 355 нм для проведения фотоманипуляций. Модификация LSM 780 NLO - это лазерный сканирующий микроскоп, оснащенный фемтосекуным мультифотонным лазером генерирующим излучение высокой плотности в инфракрасной области 680-1080 нм. Благодаря свойствам такого лазера, мы можем проникать на глубину до 500 мкм, при этом возбуждение происходит только внутри фокального микрообъема, менее 0,1 мкм3, что позволяет бережно воздействовать на живую ткань.
Технические характеристики:
Развитие генной инженерии, протеомики, биотехнологии, современной фармацевтики и биомедицины способствовало быстрому внедрению новых методов конфокальной микроскопии, и в настоящее время они широко используются в клеточной биологии. Конфокальную флуоресцентную микроскопию можно рассматривать как разновидность традиционной флуоресцентной микроскопии, которая позволяет исследовать внутреннюю микроструктуру клеток, причем не только фиксированных, но и живых, идентифицировать микроорганизмы, структуры клетки и отдельные молекулы, наблюдать динамические процессы в клетках. Конфокальная флуоресцентная микроскопия в дополнение к этому обеспечила возможность трехмерного субмикронного разрешения объекта и существенно расширила возможность неразрушающего анализа прозрачных образцов. Повышение разрешающей способности достигается благодаря использованию в конфокальных микроскопах лазеров в качестве источников света и конфокальной диафрагмы для фильтрации внефокусной флуоресценции. Преимущество лазеров по сравнению с ртутными или ксеноновыми лампами заключается в монохроматичности и высокой параллельности испускаемого пучка света. Эти свойства лазерного излучения обеспечивают более эффективную работу оптической системы микроскопа, уменьшают число бликов, улучшают точность фокусировки пучка света. На образце лазер освещает не все поле зрения, как в ламповом флуоресцентном микроскопе, а фокусируется в точку. Конечно, при этом лазерный луч возбуждает флуоресценцию как в точке фокуса, так и во всех слоях образца, через которые проходит. И если эта внефокусная флуоресценция, излучаемая слоями, расположенными выше и ниже фокальной плоскости, регистрируется вместе с основным сигналом из фокуса объектива, это ухудшает разрешение оптической системы. Избавиться от внефокусной флуоресценции позволяет конфокальная диафрагма. Изменяя диаметр конфокальной диафрагмы, можно определять толщину оптического слоя вблизи фокуса лазерного луча, поэтому флуоресценция, испускаемая выше и ниже фокуса, оказывается дефокусированной на конфокальной диафрагме и не регистрируется. Благодаря этому конфокальная микроскопия обеспечивает улучшенное разрешение, в первую очередь вдоль оси Z. Современная конфокальная микроскопия позволяет решать три основные задачи: изучение тонкой структуры клетки, колоколизации (пространственного взаиморасположения) в клетке двух или более веществ, а так же исследование динамических процессов, протекающих в живых клетках. Благодаря улучшенному разрешению, особенно повышенному разрешению по оси Z, и возможности создавать серии «оптических» срезов, конфокальный микроскоп позволяет исследовать тонкую структуру объекта в трехмерном пространстве. Специальные программы позволяют создать из серии оптических срезов объемное изображение объекта (3D) и как бы рассматривать его под разными углами зрения, что может дать ценную информацию о форме клеток, цитоскелете, структуре ядра, хромосомах и даже локализации в них отдельных генов, а так же о взаиморасположении этих элементов. Использование мультиспектрального (с несколькими флуорохромами) режима работы лазерного сканирующего конфокального микроскопа позволяет исследовать колоколизацию (пространственное взаиморасположение) в клетке двух или более разных веществ, например, белков, помеченных разными флуоресцентными красителями. Исследуя такие препараты в обычном флуоресцентном микроскопе, нельзя с уверенностью утверждать, находятся эти вещества рядом или одно под другим. С помощью метода оптических срезов и дальнейшей 3D-реконструкции объекта можно воссоздать объемное распределение веществ. Мультиспектральный режим так же позволяет проводить на конфокальном микроскопе исследования методом FISH. Возможность получать временные серии изображений с высоким пространственным разрешением позволяет исследовать изменения, происходящие в клетках и их структурах во времени (4D реконструкция). Кроме того, благодаря наличию лазеров и системы сканирования можно осуществлять не только регистрацию временных изменений, но и осуществлять воздействие на клеточные структуры лазерным излучением с одновременным наблюдением протекающих процессов. Новые методы лазерной сканирующей конфокальной микроскопии получили широкое распространение в фундаментальных науках, а также все шире применяются в практических исследованиях и диагностической медицине. Методы конфокальной микроскопии позволяют выявить способность веществ накапливаться в цитоплазме, ядре или других структурах клетки, зарегистрировать образование метаболитов, измерить кинетику накопления и метаболизма веществ в клетке, скорость выведения веществ из клетки, сравнить интенсивность метаболизма в различных клеточных линиях и в различных условиях. Эти методы все шире применяются в исследованиях механизмов действия как канцерогенов, так и лекарственных препаратов и противоопухолевых соединений, позволяют рассчитывать их эффективные концентрации. Анализ интенсивности и формы спектров собственной флуоресценции позволяет распознавать нормальные и воспаленные клетки, и такой метод, в частности, предложен в качестве нового способа ранней диагностики шейки матки. Подобрав комбинацию фильтров для нескольких типов собственной флуоресценции, возможно без проведения гистохимического окрашивания и трудоемкого получения и исследования множества срезов различать злокачественные и нормальные тканевые структуры в биопсийных пробах лимфоузлов пациентов с лимфоаденопатией различного происхождения. Методы конфокальной микроскопии широко применяются в эмбриологии и гидробиологии, ботанике, зоологии при изучении структуры гамет, развития и формирования организмов. Конфокальная микроскопия постоянно развивается, и в практику внедряются все новые методы исследований для изучения механизмов функционирования организмов на клеточном, субклеточном и молекулярном уровнях, которые с каждым днем становятся все более востребованными в прикладных исследованиях и диагностике. Появление персонального конфокального лазерного сканирующего микроскопа FV10i позволяет расширить границы применения конфокальных методик. Микроскоп FV10i выполняет те же функции, что и высокотехнологичные исследовательские конфокальные сканирующие системы FV1000. В компактный корпус интегрированы все основные компоненты: 4 диодных лазера, спектральный сканирующий детектор, интуитивно понятное программное обеспечение, инкубатор, моторизованный столик, антивибрационная платформа и даже «темная комната». Этот микроскоп идеален для тех, кто только начинает работать с конфокальным методиками, для тех, кто хотел бы освободить исследовательские конфокальные микроскопы от рутинных задач, для диагностических лабораторий, лабораторий с ограниченным бюджетом, для обучающих задач и случаев проведения исследований в условиях ограниченного комфорта, например, на биологических станциях. |
|||||||||||
|
TIRF3
|
|
|
По запросу По запросу |
|
|
||||||
|
Система предназначена для наблюдения за процессами, происходящими на поверхности клетки. Полное отражение внефокусного света позволяет получать изображения клеточной мембраны с непревзойденным разрешением. Области применения: изучение быстродвижущихся структур, исследование трансмембранного переноса (в том числе транспорта кальция), FRET. Система Флуоресценция полного внутреннего отражения с использованием лазеров в качестве источников легко сочетается со всеми известными светлопольными методами контрастирования при обеспечении надежной лазерной безопасности. Система TIRF 3 зарекомендовала себя в определении областей клеточной адгезии с высокой четкостью и разрешением, визуализации энодо- и экзоцитоза везикул с максимальной быстротой, детекции отдельных молекул с высокой контрастностью при полном подавлении фона, а также наблюдении межклеточных взаимодействий с высокой чувствительностью.
Технические характеристики:
|
|||||||||||
|
|
|||||||||||
Все поля со звездочкой (*) обязательны для заполнения
Данное действие необратимо.
чтобы сделать работу на сайте еще удобнее!
С помощью личного кабинета Вы сможете:
- моментально получать счета на оформленные заказы;
- отслеживать статусы выполнения заказа по оплате, отгрузке, наличию товаров на складе;
- вести историю заказов, повторять заказы полностью или частично;
- выбирать персонального менеджера;
- формировать списки избранного среди товаров, справочных материалов и видео;
- делать заказ со страницы избранных товаров;
- экономить время при заполнении форм заказа по каталогам и регистрации на мероприятия.