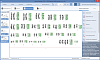
Кариотипирование — цитогенетический метод определения кариотипа (совокупность признаков полного набора хромосом биологического вида, организма, клеточной линии). Для определения кариотипа используются клетки в метафазе митоза (у человека используют, как правило, лимфоциты периферической крови, также могут быть использованы клетки костного мозга или первичная культура фибробластов кожи).
Каталоги, статьи, видео
Фильтр
Пока нет данных. Перейти в каталог
Фильтр
|
FISH 2.1
|
|
|
По запросу По запросу |
|
|
||||||
|
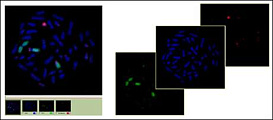
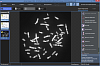
Программное обеспечение ArgusSoft для FISH анализа позволяет производить автоматические исследования по методу флуоресцентной гибридизации in situ для определения точного положения генов на хромосомах, визуализации нераспознаваемых микроскопических нарушений, определения хромосомных аберраций, оперативного установления анеуплоидности клеток, визуализации отдельных сегментов хромосом в интерфазных ядрах, установления генетического родства между отдаленными видами и т.д.
Основные возможности программы для FISH анализа:
Дополнительные возможности:
|
|||||||||||
|
ARGUS - KARYO
|
|
|
Регистрационное удостоверение на медицинское изделие
Росздравнадзора
|
По запросу По запросу |
|
|
|||||
|
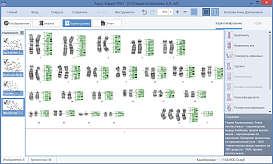
Программное обеспечение Аргус-Karyo позволяет проводить автоматическое кариотипирование и FISH-анализ хромосом человека по положению бендов, а также кариотипирование хромосом животных и растений в интерактивном режиме. Есть возможность обучения программы распознаванию хромосом, используя собственную базу хромосом.
Кариотипирование:
FISH анализ:
Документирование:
Регистрационное удостоверение Росздравнадзора № РЗН 2020/9770 от 16.03. 2020 г. ПО для цитогенетических исследований Аргус-Karyo, АргусСофт, листовка, 2 стр. |
|||||||||||
|
|
|||||||||||
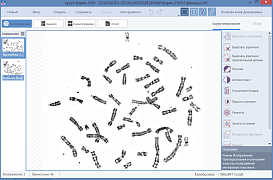
Кариотипирование — цитогенетический метод определения кариотипа (совокупность признаков полного набора хромосом биологического вида, организма, клеточной линии).
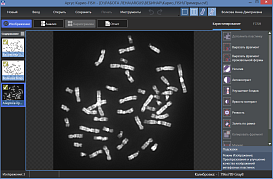
Для определения кариотипа используются клетки в метафазе митоза (у человека используют, как правило, лимфоциты периферической крови, также могут быть использованы клетки костного мозга или первичная культура фибробластов кожи). Для увеличения числа клеток на стадии метафазы к культуре клеток в специальной среде незадолго перед фиксацией добавляют колхицин, который блокирует образование микротрубочек, тем самым препятствуя расхождению хроматид к полюсам деления клетки и завершению митоза.
После фиксации препараты метафазных хромосом окрашивают и фотографируют, используя исследовательские микроскопы с цифровыми камерами. Из микрофотографий формируют кариотип — нумерованный набор пар гомологичных хромосом. Далее производится анализ полученных изображений при помощи специализированных программных инструментов.
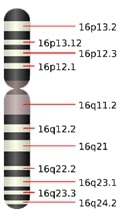 Для получения классического кариотипа используется окраска хромосом различными красителями или их смесями — в силу различий в связывании красителя с различными участками хромосом окрашивание происходит неравномерно и образуется характерная полосчатая структура (комплекс поперечных меток-banding), отражающая линейную неоднородность хромосомы и специфичная для гомологичных пар хромосом и их участков (за исключением полиморфных районов, локализуются различные аллельные варианты генов).
Для получения классического кариотипа используется окраска хромосом различными красителями или их смесями — в силу различий в связывании красителя с различными участками хромосом окрашивание происходит неравномерно и образуется характерная полосчатая структура (комплекс поперечных меток-banding), отражающая линейную неоднородность хромосомы и специфичная для гомологичных пар хромосом и их участков (за исключением полиморфных районов, локализуются различные аллельные варианты генов).
Достоинства метода: анализ структуры и количества непосредственно хромосом, выявление сбалансированных транслокаций, маркерных хромосом, мозаицизма.
Недостатки метода: невысокая разрешающая способность (10 Мб), невозможность определения микрохромосомных перестроек (делеций, дупликаций, инверсий, инсерций); качество анализа зависит от опыта исследователя и качества препаратов (морфологии хромосом, окрашивания); невозможность анализа при отсутствии делящихся клеток.
Области применения кариотипирования:
 FISH-анализ (Fluorescence In Situ Hybridization) — цитогенетический метод, применяющийся для детекции и определения положения специфической последовательности ДНК на метафазных хромосомах или в интерфазных ядрах in situ, а также для выявления специфических мРНК в образце ткани (установление пространственно-временных особенностей экспрессии генов в клетках и тканях).
FISH-анализ (Fluorescence In Situ Hybridization) — цитогенетический метод, применяющийся для детекции и определения положения специфической последовательности ДНК на метафазных хромосомах или в интерфазных ядрах in situ, а также для выявления специфических мРНК в образце ткани (установление пространственно-временных особенностей экспрессии генов в клетках и тканях).
Метод FISH-анализа использует короткие флуоресцентно-меченые последовательности ДНК (зонды), комплементарные по отношению к исследуемым последовательностям. Зонды гибридизуются (связываются) с комплементарными участками ДНК и позволяют видеть локализацию интересующих генов в составе ДНК или хромосом. Гибридизация проводится в препарате на предметном стекле с использованием специальных термостатов-гибридайзеров. Дальнейшая обработка производится путем флуоресцентной микроскопии и специального программного обеспечения.
Достоинства метода FISH-анализа: разрешающая способность — 100-300 Kб, возможность определения микрохромосомных перестроек (делеций, дупликаций, инверсий, инсерций); более объективный, относительно легкий, быстрый и хорошо воспроизводимый метод анализа; возможность проведения анализа на культурах клеток с низкой митотической активностью, фиксированных клетках и тканях (interphase FISH).
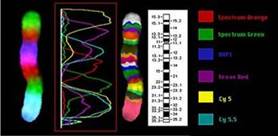 Недостаток метода: таргетный анализ (зависит от специфичности используемого ДНК-зонда).
Недостаток метода: таргетный анализ (зависит от специфичности используемого ДНК-зонда).
Области применения FISH:
Для определения кариотипа используются клетки в метафазе митоза (у человека используют, как правило, лимфоциты периферической крови, также могут быть использованы клетки костного мозга или первичная культура фибробластов кожи). Для увеличения числа клеток на стадии метафазы к культуре клеток в специальной среде незадолго перед фиксацией добавляют колхицин, который блокирует образование микротрубочек, тем самым препятствуя расхождению хроматид к полюсам деления клетки и завершению митоза.
После фиксации препараты метафазных хромосом окрашивают и фотографируют, используя исследовательские микроскопы с цифровыми камерами. Из микрофотографий формируют кариотип — нумерованный набор пар гомологичных хромосом. Далее производится анализ полученных изображений при помощи специализированных программных инструментов.
 Для получения классического кариотипа используется окраска хромосом различными красителями или их смесями — в силу различий в связывании красителя с различными участками хромосом окрашивание происходит неравномерно и образуется характерная полосчатая структура (комплекс поперечных меток-banding), отражающая линейную неоднородность хромосомы и специфичная для гомологичных пар хромосом и их участков (за исключением полиморфных районов, локализуются различные аллельные варианты генов).
Для получения классического кариотипа используется окраска хромосом различными красителями или их смесями — в силу различий в связывании красителя с различными участками хромосом окрашивание происходит неравномерно и образуется характерная полосчатая структура (комплекс поперечных меток-banding), отражающая линейную неоднородность хромосомы и специфичная для гомологичных пар хромосом и их участков (за исключением полиморфных районов, локализуются различные аллельные варианты генов). Достоинства метода: анализ структуры и количества непосредственно хромосом, выявление сбалансированных транслокаций, маркерных хромосом, мозаицизма.
Недостатки метода: невысокая разрешающая способность (10 Мб), невозможность определения микрохромосомных перестроек (делеций, дупликаций, инверсий, инсерций); качество анализа зависит от опыта исследователя и качества препаратов (морфологии хромосом, окрашивания); невозможность анализа при отсутствии делящихся клеток.
Области применения кариотипирования:
- выявление различных хромосомных аномалий (числовых и структурных);
- цитогенетический анализ животных и растений для выявления селекционной ценности, чистопородности, генетической паспортизации.
 FISH-анализ (Fluorescence In Situ Hybridization) — цитогенетический метод, применяющийся для детекции и определения положения специфической последовательности ДНК на метафазных хромосомах или в интерфазных ядрах in situ, а также для выявления специфических мРНК в образце ткани (установление пространственно-временных особенностей экспрессии генов в клетках и тканях).
FISH-анализ (Fluorescence In Situ Hybridization) — цитогенетический метод, применяющийся для детекции и определения положения специфической последовательности ДНК на метафазных хромосомах или в интерфазных ядрах in situ, а также для выявления специфических мРНК в образце ткани (установление пространственно-временных особенностей экспрессии генов в клетках и тканях). Метод FISH-анализа использует короткие флуоресцентно-меченые последовательности ДНК (зонды), комплементарные по отношению к исследуемым последовательностям. Зонды гибридизуются (связываются) с комплементарными участками ДНК и позволяют видеть локализацию интересующих генов в составе ДНК или хромосом. Гибридизация проводится в препарате на предметном стекле с использованием специальных термостатов-гибридайзеров. Дальнейшая обработка производится путем флуоресцентной микроскопии и специального программного обеспечения.
Достоинства метода FISH-анализа: разрешающая способность — 100-300 Kб, возможность определения микрохромосомных перестроек (делеций, дупликаций, инверсий, инсерций); более объективный, относительно легкий, быстрый и хорошо воспроизводимый метод анализа; возможность проведения анализа на культурах клеток с низкой митотической активностью, фиксированных клетках и тканях (interphase FISH).
 Недостаток метода: таргетный анализ (зависит от специфичности используемого ДНК-зонда).
Недостаток метода: таргетный анализ (зависит от специфичности используемого ДНК-зонда). Области применения FISH:
- преимплантационная генетическая диагностика (ПГД);
- пренатальная диагностика;
- постнатальная диагностика (уточнение/верификация результатов стандартного цитогенетического исследования; исследование сложных перестроек — тройных и более сложных транслокаций, инсерций; определение степени мозаицизма; исследование природы маркерных хромосом; исследование хромосомных перестроек в онкогематологии; диагностика солидных опухолей; скрининг анеуплоидий сперматозоидов).
Вход в личный кабинет
Оформление заказа без регистрации
Для продолжения регистрации введите ИНН
Восстановление пароля
Ссылка для восстановления пароля будет отправлена на Ваш адрес электронной почты
Регистрация пользователя
Заполните, пожалуйста, форму регистрации
Все поля со звездочкой (*) обязательны для заполнения
Все поля со звездочкой (*) обязательны для заполнения
Техподдержка пользователей
Для более быстрого оформления запроса выберите тему обращения
Отмена регистрации
Вы уверены, что хотите отменить создание учетной записи и удалить все данные?
Данное действие необратимо.
Данное действие необратимо.
Да, удалить
Нет, оставить
Зарегистрируйтесь на dia-m.ru,
чтобы сделать работу на сайте еще удобнее!
чтобы сделать работу на сайте еще удобнее!
С помощью личного кабинета Вы сможете:
- моментально получать счета на оформленные заказы;
- отслеживать статусы выполнения заказа по оплате, отгрузке, наличию товаров на складе;
- вести историю заказов, повторять заказы полностью или частично;
- выбирать персонального менеджера;
- формировать списки избранного среди товаров, справочных материалов и видео;
- делать заказ со страницы избранных товаров;
- экономить время при заполнении форм заказа по каталогам и регистрации на мероприятия.